如何「择业」?细胞也关心这问题
我们的身体由 200 多种不同类型细胞组成。如人从事不同职业一样,细胞们也有着自己不同的职责。比如,心肌细胞负责心脏的收缩和泵血功能,神经细胞负责神经信号的传递,胰岛细胞负责分泌胰岛素等。 其实,从 1 个受精卵分裂成 200 多种不同类型的细胞,细胞们也经历过一个“择业”过程,这个过程有一个专有名词,叫做“细胞命运分化”。 图 1 干细胞的自我更新、特化及分化 我们先来了解胚胎发育的几个过程。我们知道,胚胎发育是从受精卵开始的。受精卵是 1 个细胞,其细胞分裂称为“卵裂”。受精卵第一次卵裂后,就会变成 2- 细胞,第二次卵裂变成 4- 细胞……当 8- 细胞卵裂变成 16-32 个细胞的时候,就变成了桑葚一样的“胚胎”。随着细胞的继续分裂,胚胎开始着床,一个新新的小生命就逐渐成长起来。 那么,在这个过程中,细胞们是在什么时候可以选择他们的“职业”呢?他们又是怎么去“选择”呢? 研究越深入,被发现细胞的“择业”的时间越往前推近 人们对哺乳动物胚胎发育第一次细胞命运决定,也就是细胞“择业”过程的认知,以小鼠为例,主要经历了三个阶段。 第一阶段, 1967 年提出“内外模型”,认为在囊胚腔出现后,胚胎细胞有了明确的内外分布,导致第一次命运决定。 第二阶段,1981 年提出“极化模型”,认为 8- 细胞期的致密化使胚胎外表面形成了致密的细胞膜,随着细胞分裂的进行,致密化细胞膜会在子细胞中出现不同程度的继承,导致第一次细胞命运分化。 第三阶段, 2007 年以来,越来越多的证据表明,早在 4- 细胞期不同卵裂球之间就已经出现分子层面的差异,例如组蛋白修饰水平差异,即第一次细胞命运决定发生在 4- 细胞时期(图 2)。其中最早发现的一个分子叫 CARM1,是一种能够催化组蛋白 H3 第 26 位精氨酸发生甲基化修饰(H3R26me)的酶。 图 2 对小鼠胚胎发育第一次细胞命运决定的认知发展 谁在影响细胞“择业”?基因 基因控制着细胞的一切行动,当然也就包括了“择业”这个过程。一个细胞中有上万个基因,加起来叫基因组,基因组内的每个基因都有其独特的功能,开启不同的基因,就会赋予细胞不同的功能。 “择业”过程就是细胞选择开启哪一些基因的过程。如果细胞最终选择开启与心脏功能相关的基因,那么这个细胞最终会变成心脏细胞。 哺乳动物细胞的基因被组蛋白包裹着,所以组蛋白能够控制基因的打开或者关闭。H3R26me 修饰可以打开基因,而 CARM1 就是通过建立 H3R26me 修饰来开启某些“择业”基因,从而影响细胞的“择业”过程。在哺乳动物胚胎发育早期,重要的“择业”基因有 Nanog 等。 新研究:细胞的 “择业”时间在 2- 细胞期 随着高通量测序的发展,科学家们普遍认为,小鼠 2- 细胞期两个卵裂球之间已经产生了差异。 中国科学院动物研究所周琪实验室和李伟实验室一直从事重编程及早期胚胎发育的研究,对重编程的机制、细胞全能性的本质以及第一次细胞命运分化的机理充满着好奇。 他们在一项最新研究中发现,一种名为“LincGET”、在小鼠 2- 细胞发育所必需的长非编码 RNA,在小鼠 2- 和 4- 细胞期各个卵裂球之间是不均等分布的。 图 3 LincGET 在小鼠 2- 和 4- 细胞期各个卵裂球之间不均等分布 随后,他们通过显微注射的方法,对“LincGET”这个家伙开展进一步的研究。 结果表明,过表达 LincGET 能使子细胞倾向进入胚胎内部,即选择内细胞团命运。另外,在过表达 LincGET 的同时干扰 CARM1,子细胞不再倾向内细胞团命运,表明 LincGET 调控内细胞团命运倾向依赖 CARM1 (图 4)。 图 4 过表达 LincGET 能使卵裂球倾向内细胞团命运科研人员进一步发现,拥有更多 LincGET 的细胞会在基因组内建立更多的 H3R26me 修饰,打开更多的基因,尤其是一些与内细胞团命运相关的“择业”基因,比如转座序列和 Nanog,从而促进内细胞团命运倾向(图 5)。 图 5 LincGET 调控命运倾向的机制模型 该研究表明,小鼠早期胚胎发育的第一次细胞决定命运在 2- 细胞期,而其中的关键分子,就是这个内源逆转录病毒相关的长非编码 RNA——“LincGET”。 早期胚胎是最高全能性的代表,对细胞“择业”过程的探索,将会让人们对早期胚胎有更深入的认识,也为更高多能性甚至全能性干细胞的建立提供新的理论参考,驱动干细胞相关技术的发展,推动干细胞治疗走向临床。 作者:王加强来源:中国科学院动物研究所 查看知乎讨论


我们的身体由 200 多种不同类型细胞组成。如人从事不同职业一样,细胞们也有着自己不同的职责。比如,心肌细胞负责心脏的收缩和泵血功能,神经细胞负责神经信号的传递,胰岛细胞负责分泌胰岛素等。
其实,从 1 个受精卵分裂成 200 多种不同类型的细胞,细胞们也经历过一个“择业”过程,这个过程有一个专有名词,叫做“细胞命运分化”。
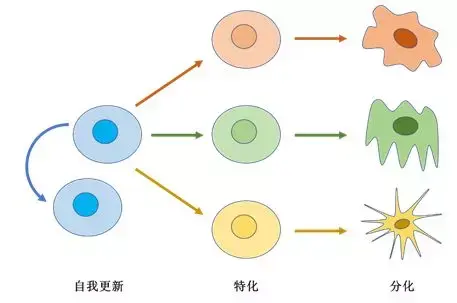
图 1 干细胞的自我更新、特化及分化
我们先来了解胚胎发育的几个过程。我们知道,胚胎发育是从受精卵开始的。受精卵是 1 个细胞,其细胞分裂称为“卵裂”。受精卵第一次卵裂后,就会变成 2- 细胞,第二次卵裂变成 4- 细胞……当 8- 细胞卵裂变成 16-32 个细胞的时候,就变成了桑葚一样的“胚胎”。随着细胞的继续分裂,胚胎开始着床,一个新新的小生命就逐渐成长起来。
那么,在这个过程中,细胞们是在什么时候可以选择他们的“职业”呢?他们又是怎么去“选择”呢?
研究越深入,被发现细胞的“择业”的时间越往前推近
人们对哺乳动物胚胎发育第一次细胞命运决定,也就是细胞“择业”过程的认知,以小鼠为例,主要经历了三个阶段。
第一阶段, 1967 年提出“内外模型”,认为在囊胚腔出现后,胚胎细胞有了明确的内外分布,导致第一次命运决定。
第二阶段,1981 年提出“极化模型”,认为 8- 细胞期的致密化使胚胎外表面形成了致密的细胞膜,随着细胞分裂的进行,致密化细胞膜会在子细胞中出现不同程度的继承,导致第一次细胞命运分化。
第三阶段, 2007 年以来,越来越多的证据表明,早在 4- 细胞期不同卵裂球之间就已经出现分子层面的差异,例如组蛋白修饰水平差异,即第一次细胞命运决定发生在 4- 细胞时期(图 2)。其中最早发现的一个分子叫 CARM1,是一种能够催化组蛋白 H3 第 26 位精氨酸发生甲基化修饰(H3R26me)的酶。
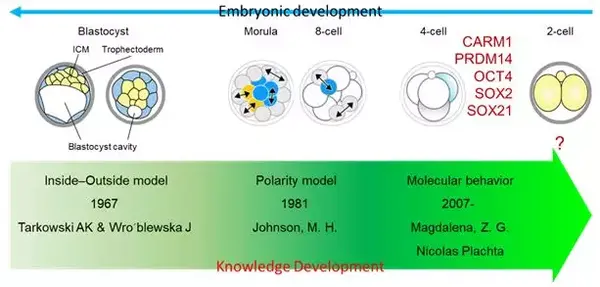
图 2 对小鼠胚胎发育第一次细胞命运决定的认知发展
谁在影响细胞“择业”?基因
基因控制着细胞的一切行动,当然也就包括了“择业”这个过程。一个细胞中有上万个基因,加起来叫基因组,基因组内的每个基因都有其独特的功能,开启不同的基因,就会赋予细胞不同的功能。
“择业”过程就是细胞选择开启哪一些基因的过程。如果细胞最终选择开启与心脏功能相关的基因,那么这个细胞最终会变成心脏细胞。
哺乳动物细胞的基因被组蛋白包裹着,所以组蛋白能够控制基因的打开或者关闭。H3R26me 修饰可以打开基因,而 CARM1 就是通过建立 H3R26me 修饰来开启某些“择业”基因,从而影响细胞的“择业”过程。在哺乳动物胚胎发育早期,重要的“择业”基因有 Nanog 等。
新研究:细胞的 “择业”时间在 2- 细胞期
随着高通量测序的发展,科学家们普遍认为,小鼠 2- 细胞期两个卵裂球之间已经产生了差异。
中国科学院动物研究所周琪实验室和李伟实验室一直从事重编程及早期胚胎发育的研究,对重编程的机制、细胞全能性的本质以及第一次细胞命运分化的机理充满着好奇。
他们在一项最新研究中发现,一种名为“LincGET”、在小鼠 2- 细胞发育所必需的长非编码 RNA,在小鼠 2- 和 4- 细胞期各个卵裂球之间是不均等分布的。
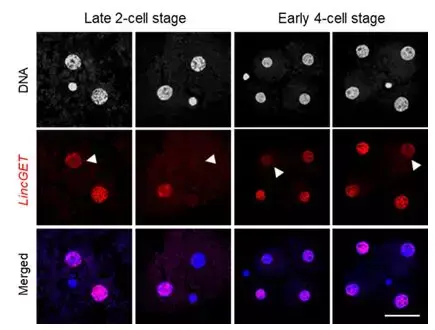
图 3 LincGET 在小鼠 2- 和 4- 细胞期各个卵裂球之间不均等分布
随后,他们通过显微注射的方法,对“LincGET”这个家伙开展进一步的研究。
结果表明,过表达 LincGET 能使子细胞倾向进入胚胎内部,即选择内细胞团命运。另外,在过表达 LincGET 的同时干扰 CARM1,子细胞不再倾向内细胞团命运,表明 LincGET 调控内细胞团命运倾向依赖 CARM1 (图 4)。
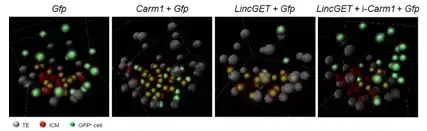
图 4 过表达 LincGET 能使卵裂球倾向内细胞团命运
科研人员进一步发现,拥有更多 LincGET 的细胞会在基因组内建立更多的 H3R26me 修饰,打开更多的基因,尤其是一些与内细胞团命运相关的“择业”基因,比如转座序列和 Nanog,从而促进内细胞团命运倾向(图 5)。
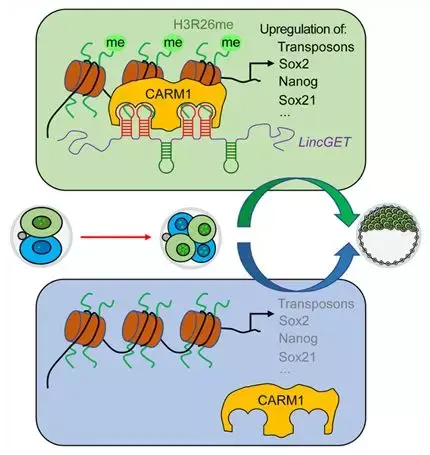
图 5 LincGET 调控命运倾向的机制模型
该研究表明,小鼠早期胚胎发育的第一次细胞决定命运在 2- 细胞期,而其中的关键分子,就是这个内源逆转录病毒相关的长非编码 RNA——“LincGET”。
早期胚胎是最高全能性的代表,对细胞“择业”过程的探索,将会让人们对早期胚胎有更深入的认识,也为更高多能性甚至全能性干细胞的建立提供新的理论参考,驱动干细胞相关技术的发展,推动干细胞治疗走向临床。
作者:王加强
来源:中国科学院动物研究所
















































